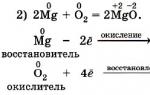Степень окисления. Определение степени окисления в соединении
Умение находить степень окисления химических элементов является необходимым условием для успешного решения химический уравнений, описывающих окислительно-восстановительные реакции. Без него вы не сможете составить точную формулу вещества, получившегося в результате реакции между различными химическими элементами. В результате решение химических задач, построенных на подобных уравнениях, будет либо невозможным, либо ошибочным.
Понятие степени окисления химического элементаСтепень окисления – это условная величина, с помощью которой принято описывать окислительно-восстановительные реакции. Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
В окислительно-восcтановительных реакциях понятие степень окисления используется для определения химических формул соединений элементов, получающихся в результате взаимодействия нескольких веществ.
На первый взгляд может показаться, что степень окисления эквивалентна понятию валентности химического элемента, но это не так. Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Как определить степень окисления конкретного химического элемента
Определение степени окисления для конкретного химического элемента подчиняется следующим правилам:
- Степень окисления простых веществ всегда равна нулю.
- Щелочные металлы, которые находятся в первой группе периодической таблицы, имеют степень окисления +1.
- Щелочноземельные металлы, занимающие в периодической таблице вторую группу, имеют степень окисления +2.
- Водород в соединениях с различными неметаллами всегда проявляет степень окисления +1, а в соединениях с металлами +1.
- Степень окисления молекулярного кислорода во всех соединениях, рассматриваемых в школьном курсе неорганической химии, равна -2. Фтора -1.
- При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
- Алюминий во всех соединениях проявляет степень окисления равную +3.
Различают высшую, низшую и промежуточную степени окисления. Высшая степень окисления, как и валентность, соответствует номеру группы химического элемента в периодической таблице, но имеет при этом положительное значение. Низшая степень окисления численно равна разности между числом 8 группой элемента. Промежуточной степенью окисления будет любой число в диапазоне от низшей степени окисления до высшей.
Чтобы помочь вам сориентироваться в многообразии степеней окисления химических элементов предлагаем вашему вниманию следующую вспомогательную таблицу. Выберите в ней интересующий вас элемент и вы получите значения его возможных степеней окисления. В скобках будут указаны редко встречающиеся значения.
Во многих школьных учебниках и пособиях учат составлять формулы по валентностям, даже для соединений с ионными связями. Для упрощения процедуры составления формул это, на наш взгляд, допустимо. Но нужно понимать, что это не совсем корректно ввиду вышеизложенной причины.
Более универсальным понятием является понятие о степени окисления. По значениям степеней окисления атомов так же как и по значениям валентности можно составлять химические формулы и записывать формульные единицы.
Степень окисления - это условный заряд атома в частице (молекуле, ионе, радикале), вычисленный в приближении того, что все связи в частице являются ионными.
Прежде чем определять степени окисления, необходимо сравнить электроотрицательности связуемых атомов. Атом с большим значением электроотрицательности имеет отрицательную степень окисления, а с меньшим положительную.
С целью объективного сравнения значений электроотрицательности атомов при расчёте степеней окисления, в 2013 году IUPAC дал рекомендацию использовать шкалу Аллена.
* Так, например, по шкале Аллена электроотрицательность азота 3,066, а хлора 2,869.
Проиллюстрируем данное выше определение на примерах. Составим структурную формулу молекулы воды.

Ковалентные полярные связи O-H обозначены синим цветом.
Представим, что обе связи являются не ковалентными, а ионными. Если бы они были ионными, то с каждого атома водорода на более электроотрицательный атом кислорода перешло бы по одному электрону. Обозначим эти переходы синими стрелками.
*В этом примере, стрелка служит для наглядной иллюстрации полного перехода электронов, а не для иллюстрации индуктивного эффекта.

Легко заметить, что число стрелок показывает количество перешедших электронов, а их направление - направление перехода электронов.
На атом кислорода направлено две стрелки, это значит, что к атому кислорода переходит два электрона: 0 + (-2) = -2. На атоме кислорода образуется заряд равный -2. Это и есть степень окисления кислорода в молекуле воды.
С каждого атома водорода уходит по одному электрону: 0 - (-1) = +1. Значит, атомы водорода имеют степень окисления равную +1.

Сумма степеней окисления всегда равняется общему заряду частицы.
Например, сумма степеней окисления в молекуле воды равна: +1(2) + (-2) = 0. Молекула - электронейтральная частица.
Если мы вычисляем степени окисления в ионе, то сумма степеней окисления, соответственно, равна его заряду.
Значение степени окисления принято указывать в верхнем правом углу от символа элемента. Причём, знак пишут впереди числа . Если знак стоит после числа - то это заряд иона.
Например, S -2 - атом серы в степени окисления -2, S 2- - анион серы с зарядом -2.
S +6 O -2 4 2- - значения степеней окисления атомов в сульфат-анионе (заряд иона выделен зелёным цветом).
Теперь рассмотрим случай, когда соединение имеет смешанные связи: Na 2 SO 4 . Связь между сульфат-анионом и катионами натрия - ионная, связи между атомом серы и атомами кислорода в сульфат-ионе - ковалентные полярные. Запишем графическую формулу сульфата натрия, а стрелками укажем направление перехода электронов.
*Структурная формула отображает порядок ковалентных связей в частице (молекуле, ионе, радикале). Структурные формулы применяют только для частиц с ковалентными связями. Для частиц с ионными связями понятие структурной формулы не имеет смысла. Если в частице имеются ионные связи, то применяют графическую формулу.

Видим, что от центрального атома серы уходит шесть электронов, значит степень окисления серы 0 - (-6) = +6.
Концевые атомы кислорода принимают по два электрона, значит их степени окисления 0 + (-2) = -2
Мостиковые атомы кислорода принимают по два электрона, их степень окисления равна -2.
Определить степени окисления возможно и по структурно-графической формуле, где черточками указывают ковалентные связи, а у ионов указывают заряд.
В этой формуле мостиковые атомы кислорода уже имеют единичные отрицательные заряды и к ним дополнительно приходит по электрону от атома серы -1 + (-1) = -2, значит их степени окисления равны -2.
Степень окисления ионов натрия равна их заряду, а т.е. +1.

Определим степени окисления элементов в надпероксиде (супероксиде) калия. Для этого составим графическую формулу супероксида калия, стрелочкой покажем перераспределение электронов. Связь O-O является ковалентной неполярной, поэтому в ней перераспределение электронов не указывается.
* Надпероксид-анион является ион-радикалом. Формальный заряд одного атома кислорода равен -1, а другого, с неспаренным электроном, 0.

Видим, что степень окисления калия равна +1. Степень окисления атома кислорода, записанного в формуле напротив калия, равна -1. Степень окисления второго атома кислорода равна 0.
Точно также можно определить степени окисления и по структурно-графической формуле.

В кружочках указаны формальные заряды иона калия и одного из атомов кислорода. При этом значения формальных зарядов совпадают со значениями степеней окисления.
Так как оба атома кислорода в надпероксид-анионе имеют разные значения степени окисления, то можно вычислить средне-арифметическую степень окисления кислорода.
Она будет равна / 2 = - 1/2 = -0,5.
Значения среднеарифметических степеней окисления обычно указывают в брутто-формулах или формульных единицах, чтобы показать что сумма степеней окисления равна общему заряду системы.
Для случая с надпероксидом: +1 + 2(-0,5) = 0

Легко определить степени окисления используя электронно-точечные формулы, в которых указывают точками неподеленные электронные пары и электроны ковалентных связей.

Кислород - элемент VIА - группы, следовательно в его атоме 6 валентных электронов. Представим, что в молекуле воды связи ионные, в этом случае атом кислорода получил бы октет электронов.
Степень окисления кислорода соответственно равна: 6 - 8 = -2.
А атомов водорода: 1 - 0 = +1
Умение определять степени окисления по графическим формулам бесценно для понимания сущности этого понятия, так же это умение потребуется в курсе органической химии. Если же мы имеем дело с неорганическими веществами, то необходимо уметь определять степени окисления по молекулярным формулам и формульным единицам.
Для этого прежде всего нужно понять, что степени окисления бывают постоянными и переменными. Элементы, проявляющие постоянную степень окисления необходимо запомнить.

Любой химический элемент характеризуется высшей и низшей степенями окисления.
Низшая степень окисления - это заряд, который приобретает атом в результате приёма максимального количества электронов на внешний электронный слой.
Ввиду этого, низшая степень окисления имеет отрицательное значение, за исключением металлов, атомы которых электроны никогда не принимают ввиду низких значений электроотрицательности. Металлы имеют низшую степень окисления равную 0.
Большинство неметаллов главных подгрупп старается заполнить свой внешний электронный слой до восьми электронов, после этого атом приобретает устойчивую конфигурацию (правило октета ). Поэтому, чтобы определить низшую степень окисления, необходимо понять сколько атому не хватает валентных электронов до октета.
Например, азот - элемент VА группы, это значит, что в атоме азота пять валентных электронов. До октета атому азота не хватает трёх электронов. Значит низшая степень окисления азота равна: 0 + (-3) = -3
Степень окисления - условная величина, использующаяся для записи окислительно-восстановительных реакций. Для определения степени окисления используется таблица окисления химических элементов.
Значение
Степень окисления основных химических элементов основана на их электроотрицательности. Значение равно числу смещённых в соединениях электронов.
Степень окисления считается положительной, если электроны смещаются от атома, т.е. элемент отдаёт электроны в соединении и является восстановителем. К таким элементам относятся металлы, их степень окисления всегда положительная.
При смещении электрона к атому значение считается отрицательным, а элемент - окислителем. Атом принимает электроны до завершения внешнего энергетического уровня. Окислителями является большинство неметаллов.
Простые вещества, не вступающие в реакцию, всегда имеют нулевую степень окисления.

Рис. 1. Таблица степеней окисления.
В соединении положительную степень окисления имеет атом неметалла с меньшей электроотрицательностью.
Определение
Определить максимальную и минимальную степень окисления (сколько электронов может отдавать и принимать атом) можно по периодической таблице Менделеева.
Максимальная степень равна номеру группы, в которой находится элемент, или количеству валентных электронов. Минимальное значение определяется по формуле:
№ (группы) – 8.

Рис. 2. Таблица Менделеева.
Углерод находится в четвёртой группе, следовательно, его высшая степень окисления +4, а низшая - -4. Максимальная степень окисления серы +6, минимальная - -2. Большинство неметаллов всегда имеет переменную - положительную и отрицательную - степень окисления. Исключением является фтор. Его степень окисления всегда равна -1.
Следует помнить, что к щелочным и щелочноземельным металлам I и II групп соответственно, это правило не применимо. Эти металлы имеют постоянную положительную степень окисления - литий Li +1 , натрий Na +1 , калий K +1 , бериллий Be +2 , магний Mg +2 , кальций Ca +2 , стронций Sr +2 , барий Ba +2 . Остальные металлы могут проявлять разную степень окисления. Исключением является алюминий. Несмотря на нахождение в III группе, его степень окисления всегда +3.

Рис. 3. Щелочные и щелочноземельные металлы.
Из VIII группы высшую степень окисления +8 могут проявлять только рутений и осмий. Находящиеся в I группе золото и медь проявляют степень окисления +3 и +2 соответственно.
Запись
Чтобы правильно записывать степень окисления, следует помнить о нескольких правилах:
- инертные газы не вступают в реакции, поэтому их степень окисления всегда равна нулю;
- в соединениях переменная степень окисления зависит от переменной валентности и взаимодействия с другими элементами;
- водород в соединениях с металлами проявляет отрицательную степень окисления - Ca +2 H 2 −1 , Na +1 H −1 ;
- кислород всегда имеет степень окисления -2, кроме фторида кислорода и пероксида - O +2 F 2 −1 , H 2 +1 O 2 −1 .
Что мы узнали?
Степень окисления - условная величина, показывающая, сколько электронов принял или отдал атом элемента в соединении. Величина зависит от количества валентных электронов. Металлы в соединениях всегда имеют положительную степень окисления, т.е. являются восстановителями. Для щелочных и щелочноземельных металлов степень окисления всегда одинаковая. Неметаллы, кроме фтора, могут принимать положительную и отрицательную степень окисления.
Тест по теме
Оценка доклада
Средняя оценка: 4.5 . Всего получено оценок: 247.
Химия подготовка к ЗНО и ДПА
Комплексное издание
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Степень окисления
Степень окисления - это условный заряд на атоме в молекуле или кристалле, который возник на нем, когда бы все полярные связи, созданные им, имели ионный характер.
На отличие от валентности, степени окисления может быть положительным, отрицательным или равняться нулю. В простых ионных соединениях степень окисления совпадает с зарядами ионов. Например, в натрий хлориде
NaCl (Na + Cl - ) Натрий имеет степень окисления +1, а Хлор -1, в кальций оксиде СаО (Са +2 О -2) Кальций проявляет степень окисления +2, а Оксисен - -2. Это правило распространяется на все основные оксиды: степень окисления металлического элемента равен заряду иона металла (Натрия +1, Бария +2, Алюминия +3), а степень окисления Кислорода равна-2. Степень окисления обозначают арабскими цифрами, которые ставят над символом элемента, подобно валентности, причем вначале указывают знак заряда, а потом его численное значение:Если модуль степени окисления равна единице, то число «1» можно не ставить и писать только знак:
Na + Cl - .Степень окисления и валентность - родственные понятия. Во многих соединениях абсолютная величина степени окисления элементов совпадает с их валентностью. Однако существует немало случаев, когда валентность отличается от степени окисления.
В простых веществах - неметалах существует ковалентная неполярная связь, совместная электронная пара смещается к одному из атомов, поэтому степень окисления элементов в простых веществ всегда равна нулю. Но атомы друг с другом связаны, то есть проявляют определенную валентность, как, например, в кислороде валентность Кислорода равна II, а в азоте валентность Азота - III:
В молекуле водород пероксида валентность Кислорода также равна II, а Водорода - И:
Определение возможных степеней окисления элементов
Степени окисление, какие элементы могут проявлять в различных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по местом элемента в Периодической системе.
Атомы металлических элементов могут только отдавать электроны, поэтому в соединениях они проявляют положительные степени окисления. Его абсолютное значение во многих случаях (за исключением d -элементов) равен числу электронов на внешнем уровне, то есть номера группы в Периодической системе. Атомы d -элементов могут также отдавать электроны с передзовнішнього уровня, а именно - с незаполненных d -орбиталей. Поэтому для d -элементов определить все возможные степени окисления значительно сложнее, чем для s - и р-элементов. С уверенностью можно утверждать, что большинство d -элементов проявляют степень окисления +2 благодаря электронам внешнего электронного уровня, а максимальная степень окисления в большинстве случаев равен номеру группы.
Атомы неметаллических элементов могут проявлять как положительные, так и отрицательные степени окисление, в зависимости от того, с атомом какого элемента они образуют связь. Если элемент более электроотрицательным, то он проявляет негативное степень окисления, а если менее электроотрицательный - положительный.
Абсолютное значение степени окисления неметаллических элементов можно определить по строению внешнего электронного слоя. Атом способен принять столько электронов, чтобы на его внешнем уровне расположилось восемь электронов: неметаллические элементы VII группы принимают один электрон и проявляют степень окисления -1, VIгруппы - два электроны и проявляют степень окисления -2 и т.д.
Неметаллические элементы способны отдавать разное число электронов: максимум столько, сколько расположено на внешнем энергетическом уровне. Иначе говоря, максимальный степень окисления неметаллических элементов равна номеру группы. Благодаря промотуванню электронов на внешнем уровне атомов число неспаренных электронов, которые атом может отдавать в химических реакциях, бывает разным, поэтому неметаллические элементы способны обнаруживать различные промежуточные значения степени окисления.
Возможны степени окисления s - и р-элементов
|
Группа ПС |
|||||||
|
Высшую степень окисления |
|||||||
|
Промежуточный степень окисления |
|||||||
|
Ниже степень окисления |
Определение степеней окисления в соединениях
Любая электронейтральная молекула, поэтому сумма степеней окисления атомов всех элементов должна равняться нулю. Определим степень окисления в сульфур(И V ) оксиде SO 2 тауфосфор(V ) сульфіді P 2 S 5 .
Сульфур(И V ) оксид SO 2 образован атомами двух элементов. Из них электроотрицательности большая у Кислорода, поэтому атомы Кислорода будут иметь негативный степень окисления. Для Кислорода он равен-2. В этом случае Сульфур оказывает положительное степень окисления. В различных соединениях Сульфур может проявлять разные степени окисления, поэтому в этом случае его необходимо вычислить. В молекуле SO 2 два атома Кислорода со степенью окисления -2, поэтому общий заряд атомов Кислорода равна-4. Для того, чтобы молекула была електронейтральною, атом Серы имеет полностью нейтрализовать заряд обоих атомов Кислорода, поэтому степень окисления Серы равна +4:
В молекуле фосфор(V ) сульфида P 2 S 5 более електронегативним элементом является Сульфур, то есть он проявляет негативное степень окисления, а Фосфор - положительный. Для Серы негативный степень окисления составляет только 2. Вместе пять атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Сложнее вычислять степень окисления не в бинарных соединениях - солях, основаниях и кислотах. Но для этого также следует воспользоваться принципом электронейтральности, а еще помнить о том, что в большинстве соединений степень окисления Кислорода составляет -2, Водорода +1.
Рассмотрим это на примере калий сульфата K 2 SO 4 . Степень окисления Калия в соединениях может быть только +1, а Кислорода -2:
С принципа электронейтральности вычисляем степень окисления Серы:
2(+1) + 1 (х) + 4 (-2) = 0, откуда х = +6.
При определении степеней окисления элементов в соединениях следует придерживаться таких правил:
1. Степень окисления элемента в простом веществе равна нулю.
2. Фтора - наиболее электроотрицательный химический элемент, поэтому степень окисления Фтора в всех соединениях равна-1.
3. Оксиген - наиболее электроотрицательный элемент после Фтора, поэтому степень окисления Кислорода во всех соединениях, кроме фторидов, отрицательный: в большинстве случаев он равна -2, а в пероксидах - -1.
4. Степень окисления Водорода в большинстве соединений равна +1, а в соединениях с металлическими элементами (гидридах) - -1.
5. Степень окисления металлов в соединениях всегда положительный.
6. Более электроотрицательный элемент всегда имеет отрицательный степень окисления.
7. Сумма степеней окисления всех атомов в молекуле равна нулю.
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от
реально существующих зарядов у ионов,
степень окисления показывает лишь
условный заряд атома в молекуле. Она
может быть отрицательной, положительной
и нулевой. Например, степень окисления
атомов в простых веществах равна «0»
(, ,
, ,
, ).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной
кислоты H 2 SO 4
атом водорода имеет степень окисления
+1, а атом кислорода -2. Так как атомов
водорода два, а атомов кислорода четыре,
то мы имеем два «+» и восемь «-». До
нейтральности не хватает шесть «+».
Именно это число и является степенью
окисления серы -
 .
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 (
.
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 ( ).
).
Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F 2 , O 2 , Cl 2 , S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe 3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO 4 -);
3) перекисные соединения.
Конкретными
веществами, применяемыми на практике
в качестве окислителей, являются кислород
и озон, хлор, бром, перманганаты, дихроматы,
кислородные кислоты хлора и их соли
(например,
 ,
, ,
, ),
азотная кислота (
),
азотная кислота ( ),
концентрированная серная кислота
(
),
концентрированная серная кислота
( ),
диоксид марганца (
),
диоксид марганца ( ),
пероксид водорода и пероксиды металлов
(
),
пероксид водорода и пероксиды металлов
( ,
, ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe 2+);
3) простые элементарные анионы, например, сульфид-ион S 2- ;
4) кислородосодержащие
анионы (оксоанионы), соответствующие
низшим положительным степеням окисления
элемента (нитрит
 ,
сульфит
,
сульфит ).
).
Конкретными
веществами, применяемыми на практике
в качестве восстановителей, являются,
например, щелочные и щелочноземельные
металлы, сульфиды, сульфиты, галогенводороды
(кроме HF),
органические вещества – спирты,
альдегиды, формальдегид, глюкоза,
щавелевая кислота, а также водород,
углерод, моноксид углерода ( )
и алюминий при высоких температурах.
)
и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO 2 - в кислой среде выступает в роли окислителя по отношению к иону I - :
2 +
2
+
2 + 4HCl→
+ 4HCl→
 +
2
+
2 + 4KCl
+ 2H 2 O
+ 4KCl
+ 2H 2 O
и в роли восстановителя по отношению к перманганат-иону MnO 4 -
5 +
2
+
2 + 3H 2 SO 4
→ 2
+ 3H 2 SO 4
→ 2 +
5
+
5 +K 2 SO 4
+ 3H 2 O
+K 2 SO 4
+ 3H 2 O